Вроджений імунітет та бактерії: як кальпротетин використовує цинк для придушення збудників – новий погляд на молекулярні механізми
У світі, де боротьба з бактеріальними інфекціями стає все складнішим завданням, розуміння тонкощів роботи вродженого імунітету стає критичним. Недавнє дослідження, опубліковане в журналіБілкова наука, проливає світло на один з ключових механізмів цього захисту – роль кальпротектину, нейтрофільного білка, у збереженні цинку та придушення росту бактерій. Ця робота, заснована на отриманні перших кристалічних структур цинкового каліпротектину, відкриває нові перспективи розробки ефективних стратегій боротьби з стійкими збудниками, особливо в контексті утворення біофіллів.
Як досвідчений структурний біолог, мене завжди цікавило, як білки взаємодіють з металами, оскільки ця взаємодія часто відіграє ключову роль у біологічних процесах. У цьому випадку здатність кальпроротетіну з’єднувати цинк з високою спорідненістю та позбавляти бактерій цього життєво важливого мікроелемента є потужним інструментом імунної системи. Споруючись з різними структурами білків, що зв’язують метал, я був переконаний, що геометрія зв’язування має величезний вплив на спорідненість та специфічність взаємодії. Отримані структури кальпротектину дозволяють заглянути всередину цієї взаємодії на атомному рівні, що є справжнім проривом.
Цинк – життєво важливий ресурс для бактерій та цілі для імунітету
Цинк є ключовим компонентом багатьох бактеріальних ферментів, що беруть участь у метаболізмі, реплікації ДНК та утворенню клітинної стінки. Тому позбавлення бактерій цинку ефективно припиняє їх ріст та розмноження. Саме ця стратегія використовує Калпротестин, пов’язуючи цинк і роблячи його недоступним для збудників. Ця концепція, хоча теоретично відома, давно залишається незрозумілою з точки зору молекулярних деталей. До недавнього часу у нас були лише загальні уявлення про те, як Калпротестин з’єднує цинк, але не знав точної геометрії цієї взаємодії.
Розкриття структури: Октаедрська клітка та роль гнучкого хвоста
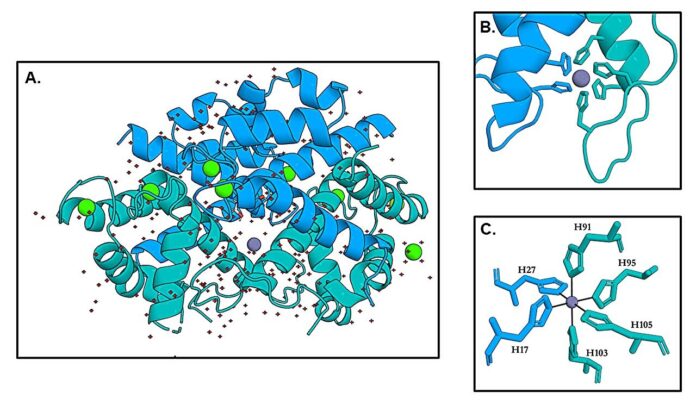
Нові кристалічні структури кальпротектину, отримані дослідниками, забезпечують безпрецедентний погляд на цей процес. Цинк розташований у клітці Octaedron, що утворюється шістьма гістидинами, взятою з двох субодиниць кальпротетину (S100A8 та S100A9). У той же час цинк на місці його Хісесп координується тетраедрично. Це відкриття підтверджує, що Калпротестин може вмістити цинк з усіма шістьма гістідинами, що є унікальною особливістю.
Особливо цікава роль гнучкого хвоста C-Tow’s S100A9. Незважаючи на те, що хвіст бере участь у завершенні координації Октаедра, яка дозволяє клітині “закрити”, дослідники виявили, що навіть коли вона видаляється або модифікується, навігація кальпротектину до цинку залишається неймовірно високою – пімомолярною. Це говорить про те, що основна сила утримання цинку пояснюється взаємодією з іншими гістідинами, а хвіст виконує роль стабілізатора, що забезпечує оптимальну геометрію.
Спілкування між структурою та функцією: вплив на ріст та утворення біофіли
Отримані дані про структуру та спорідненість кальпротектину до цинку мають далекосяжні наслідки для розуміння його біологічної ролі. Дослідження показали, що кальпротектин значно обмежує зростанняStaphylococcus aureus Поширений збудник, який викликає різні інфекції. У той же час, порушення взаємодії кальпротектину з металами майже повністю виключає цей ефект.
Більше того, дослідники виявили, що цілісність хвоста S100A9 впливає не лише на утримання цинку, але і на утворення біофіли. Модифікація або видалення хвоста призводить до зміни складу біомаси та асоціації кальпротектину з бактеріальними спільнотами. Це вказує на те, що кальпротетин діє не лише як “голод” для бактерій, але й як регулятор утворення біофіли, що впливає на їх структуру та склад.
Клінічні перспективи: нові підходи до боротьби з стійкими інфекціями
Розуміння молекулярних механізмів дії кальцію відкриває нові можливості для розробки ефективних стратегій боротьби з стійкими інфекціями. Зокрема, можна використовувати такі підходи:
- Іммобілізація цинку: Створення штучних клітин, багатих гістидідинами, які будуть наказано зв’язуватися з цинком, забезпечуючи його ефективну іммобілізацію та позбавлення бактерій цього мікроелементу.
- Посилення взаємодії хвоста: Розробка сполук, які сприятимуть контактам між кальпротектином та бактеріальними поверхнями, доповнюючи вплив антибіотиків та витісняючи рівновагу до менш пристосованої, багатої ДНК біомаси.
- Модуляція імунної відповіді: Стимуляція вироблення кальцію або розвиток аналогів з вдосконаленими властивостями для підвищення захисту від імунітету від інфекцій.
Особистий досвід та думки
Як структурний біолог, я завжди захоплювався здатністю створювати неймовірно ефективні молекулярні машини. Робота з Кальпротектином – яскравий приклад цього. Отримані кристалічні структури не тільки виявили деталі взаємодії кальпротектину з цинком, але й продемонстрували, наскільки тонка ця система для придушення бактеріальних інфекцій.
Здатність Кальпротектину особливо вражає адаптуватися до різних умов. Зберігання цинку залишається надійним навіть при зміні або видаленні хвоста, що вказує на високу ступінь оптимізації цієї системи. Я впевнений, що подальші дослідження в цьому напрямку призведуть до нових відкриттів та розробки ефективних методів боротьби з стійкими інфекціями.
Висновок
Вивчення ролі кальпротектину у збереженні цинку та придушення росту бактерій є важливим кроком до розуміння механізмів вродженого імунітету. Отримані кристалічні структури та дані про спорідненість Кальпротектину до цинку відкривають нові перспективи розвитку ефективних стратегій боротьби з стійкими інфекціями, особливо в контексті утворення біофіли. Використання цих знань для створення нових методів лікування та запобігання інфекцій може значно покращити якість життя мільйонів людей у всьому світі.